Adiponectine
L'adiponectine est une adipocytokine, c'est-à-dire une hormone produite par le tissu adipeux, qui est impliquée, entre autres, dans la régulation du métabolisme des lipides et du glucose.
L'adiponectine est une adipocytokine, c'est-à-dire une hormone produite par le tissu adipeux, qui est impliquée, entre autres, dans la régulation du métabolisme des lipides et du glucose.
Généralités
L'adiponectine a été découverte dans les années 1990 par quatre groupes de recherche indépendants et c'est pour cette raison que différentes appellations lui ont été données : AdipoQ, Acr30 (adipocyte complement-related protein of 30 kD), APM1 (adipose most abundant gene transcript 1), et GBP28 (gelatin-binding protein of 28 kD. Elle appartient à la famille des protéines contenant des séquences homologues au domaine globulaire de la protéine Cq1[1]. Cette hormone est un polypeptide de 244 acides aminés dont le poids moléculaire représente à peu près 28 kilodaltons[2]. Son gène est localisé sur le chromosome 3, exactement sur le locus 3q27 et s'étale sur 16 kilobases composés de 3 exons et de 2 introns[3]. Il y a peu de temps, un locus de susceptibilité pour le diabète de type 2 et le syndrome métabolique a été déterminé sur le même locus où se trouve le gène codant l'adiponectine. Ceci veut dire que des mutations au niveau du gène de cette hormone pourraient être impliquées dans certains désordres métaboliques[4].
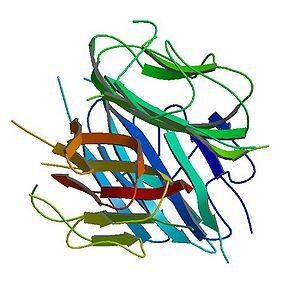
Structure
La protéine se compose de 4 domaines : une séquence de signal sur la région amine terminale suivie d'une région variable sans spécificité, d'un domaine collagène et d'un domaine globulaire carboxyle terminal[1]. Le domaine C-terminal est pourvu de la majeure partie de l'activité biologique de l'hormone. L'adiponectine se retrouve dans le plasma sous diverses formes moléculaires : une forme monomérique de 30kDa et une forme multimérique (monomères d'adiponectine organisés en une structure grâce à des ponts disulfures). Parmi les multimères, on distingue les hexamères (190 kDa) et les formes de haut poids moléculaire (> 300 kDa). Ces structures sont retrouvées dans le plasma et plusieurs études démontrent que la majorité de l'adiponectine circulante se retrouve sous forme de complexes de haut poids moléculaire (>80%). Par contre, on ne connaît pas encore les rôles physiologiques et les facteurs de régulation de ces formes circulantes d'adiponectine[5].
Sécrétion et expression
L'adiponectine est surtout sécrétée par le tissu adipeux, mais également par des cellules non adipeuses comme les ostéoblastes[2], et compte pour 0, 01% des protéines plasmatiques totales chez l'humain[6]. Chez un individu en santé, ses concentrations se situent entre 5 et 10 μg/ml[7]. Sa synthèse est régulée par plusieurs mécanismes faisant intervenir d'autres molécules. A titre d'exemple, l'insuline et l'IGF-1 (insulin-like growth factor-1) l'augmentent, tandis que les
Récepteurs
Pour exercer ses effets biologiques, l'adiponectine doit se lier à des récepteurs et il semble probable que des altérations au niveau de ceux-ci modifient les effets biologiques de l'hormone. Ces récepteurs s'appellent AdipoR1 et AdipoR2. L'AdipoR1 est abondamment exprimé dans le muscle, tandis que l'AdipoR2 est exprimé en grande quantité dans le foie. L'expression de ces deux récepteurs semble dépendre des niveaux d'insuline, car ils sont retrouvés en moindre quantité dans les modèles de souris diabétiques[1].
Actions sur le métabolisme
Un taux d'adiponectine élevé diminuerait le risque de diabète de type II. l'insuline[11]. De façon générale, l'adiponectine exerce son rôle anti-diabétique au niveau du foie et du muscle squelettique en augmentant la sensibilité à l'insuline de ces organes. Au niveau hépatique, elle contribue à diminuer la production de glucose ainsi qu'à diminuer le contenu en triglycérides pour ainsi faciliter une augmentation de la sensibilité à l'insuline. Dans le muscle squelettique, l'adiponectine permet une augmentation de l'entrée de glucose et une augmentation de l'oxydation des acides gras, phénomènes contribuant aussi à perfectionner la sensibilité à l'insuline. De plus, l'insulino-résistance est caractérisée par une augmentation des acides gras libres dans le plasma et dans les muscles, ce qui induit une accumulation de lipides dans les organes. De par ces actions anti-diabétiques, l'adiponectine empêche le développement d'une lipotoxicité. Les mécanismes moléculaires impliqués dans ces effets métaboliques sont peu connus, mais certaines études ont établi un lien avec l'AMPK (AMP-activated protein kinase), une enzyme clé dans la régulation du métabolisme des glucides et des lipides. Via l'activation de l'AMPK, l'adiponectine joue un rôle important dans la régulation de l'oxydation des acides gras. L'AMPK possède la capacité de phosphoryler et d'inactiver l'ACC (Acétyl-Cœnzyme A Carboxylase) diminuant ainsi les concentrations du malonyl-CoA, dont la production nécessite la présence de l'enzyme ACC. Une diminution du malonyl-CoA génère d'importantes répercussions sur l'oxydation des acides gras puisque ce dernier est un inhibiteur de la CPT-1 (Carnitine palmitoyltransférase-1) qui contrôle l'entrée des acides gras dans la mitochondrie. Ainsi, quand l'activité de l'ACC est inhibée, les concentrations de malonyl-CoA s'abaissent, la CPT-1 n'est plus inhibée et une quantité plus grande d'acides gras peut être oxydée. Par conséquent, une diminution des triglycérides musculaires et hépatiques peut contribuer à perfectionner la transduction du signal de l'insuline. L'adiponectine augmente aussi la translocation des transporteurs GLUT4 du cytoplasme vers la membrane plasmique et favorise ainsi la captation de glucose par les tissus. De nombreuses études ont démontré les propriétés anti-athérogéniques et anti-inflammatoires de l'adiponectine via ses effets sur d'autres cytokines comme le TNF-alpha ou la CRP. L'adiponectine module directement ou indirectement les cascades inflammatoires en modifiant l'action et la production de cytokines inflammatoires, pouvant par conséquent jouer un rôle dans le processus d'athérosclérose[1]. Aussi, elle a été associée à la dyslipidémie dans plusieurs études ainsi qu'à l'hypertension ce qui fait dire qu'il existe une forte corrélation entre les niveaux sanguins d'adiponectine et les composantes du syndrome métabolique.
L'adiponectine pourrait par conséquent prédire un certain nombre de maladies métaboliques. L'association entre les niveaux circulants d'adiponectine et les complications métaboliques associées à l'obésité est actuellement plus qu'évidente. L'excès du tissu adipeux est associé à la résistance à l'insuline ainsi qu'à un profil métabolique détérioré et que ceci peut être corrigé par l'administration d'adiponectine.
Identité dans les banques de données
- Entrez Protein (RefSeq) : NP_004788
- Unigene : Hs. 80485
- Entrez Nucleotide (Corenucleotide) :NM_004797
Références
- Kadowaki T. et Yamauchi T., “Adiponectin and Adiponectin Receptors”, Endocrine Reviews. 2005; 26 (3) : 439-451. PMID : 15897298
- Whitehead J. P., Richards A. A., Hickman I. J., Macdonald G. A. et Prins J. B., “Adiponectin – a key adipokine in the metabolic syndrome”, Diabetes, Obesity and Metabolism. 2006; 8 (3) ; 264-280. PMID : 16634986
- ↑ Schäffler A., Orsó E., Palitzsch K. D., Büchler C., Drobnik W., Fürst A., Schölmerich J. et Schmitz G., “ The human apM-1, an adipocyte-specific gene linked to the family of TNF's and to genes expressed in activated T cells, is mapped to chromosome 1q21.3-q23, a susceptibility locus identified for familial combined hyperlipidæmia (FCH) ”, Biochem Biophys Res Commun 1999; 260 (2) : 416-425. PMID : 10403784
- ↑ Comuzzie A. G., Funahashi T., Sonnenberg G., Martin L. J., Jacob H. J., Black A. E., Maas D., Takahashi M., Kihara S., Tanaka S., Matsuzawa Y., Blangero J., Cohen D. et Kissebah A., “The genetic basis of plasma variation in adiponectin, a global endophenotype for obesity and the metabolic syndrome”, J Clin Endocrinol Metab 2001; 86 (9) : 4321-4325. PMID : 11549668
- Lafontan M. et Viguerie N., “Role of adipokines in the control of energy metabolism : focus on adiponectin”, Current Opinion in Pharmacology . 2006; 6 (6) : 580-585. PMID : 16973420
- ↑ Hopkins T. A., Ouchi N., Shibata R. et Walsh K., “Adiponectin actions in the cardiovascular system”, Cardiovascular Research. 2007; 74 (1) : 11-18. PMID : 17140553
- ↑ Matsuzawa Y., “The metabolic syndrome and adipocytokines”, FEBS Letters . 2006; 580 (12) : 2917-2921. PMID : 16674947
- ↑ Stefan N. et Stumvoll M., “ Adiponectin--its role in metabolism and beyond”, Horm Metab Res. 2002; 34 (9) : 469-474. PMID : 12384822
- ↑ Trujillo M. E. et Scherer P. E. “Adiponectin--journey from an adipocyte secretory protein to biomarker of the metabolic syndrome”, J Intern Med. 2005; 257 (2) : 167-175. PMID : 15656875
- ↑ Pajvani U. B. et Scherer P. E., “Adiponectin : systemic contributor to insulin sensitivity”, Curr Diab Rep. 2003; 3 (3) : 207-213. PMID : 12762967
- ↑ Shanshan Li, Hyun Joon Shin, Ding EL, , van Dam RM, Adiponectin levels and risk of type 2 diabetes, a zystematic review and meta-analysis, JAMA, 2009;302 :179-188
Recherche sur Google Images : |
|
"de l'adiponectine qui" L'image ci-contre est extraite du site www-good.ibl.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (480 x 360 - 20 ko - gif)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité