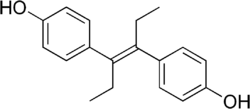
Diéthylstilbestrol
Le diéthylstilbestrol est un œstrogène de synthèse. Il est synthétisé au Royaume-Uni en 1938, en premier lieu commercialisé comme médicament dans ce pays sous le nom de Stilbestrol-Limite, puis dans d'autres pays sous le nom de Distilbène.

Catégories :
Produit chimique toxique - Produit chimique dangereux pour l'environnement - Cancérogène chimique - Produit chimique reprotoxique - Pharmacie - Obstétrique - Histoire de la médecine - Tératogène - Mutagène - Estrogène synthétique - Estrogène - Stéroïde sexuel - Hormone sexuelle - Hormone - Médicament retiré du marché français - Stilbénoïde - Phénol
| Diéthylstilbestrol | |||
|---|---|---|---|
 |
|||
| Général | |||
| Synonymes | DES | ||
| No CAS | cis + trans : |
||
| No EINECS | |||
| Code ATC | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | Solide | ||
| Propriétés chimiques | |||
| Formule brute | C18H20O2 [Isomères] |
||
| Masse molaire | 268, 3502 g∙mol-1 C 80, 56 %, H 7, 51 %, O 11, 92 %, |
||
| Propriétés physiques | |||
| T° fusion | 170, 5 °C | ||
| Solubilité | 12 mg/L eau à 25 °C. 0.1 g/mL méthanol |
||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 36/37/38, 45, 51/53, 61, | |||
| Phrases S : 36/37/39, 45, 53, 60, 61, | |||
|
|
|||
| Groupe 1 : Cancérogène pour l'homme[1] | |||
| Écotoxicologie | |||
| DL50 | >3000 mg/kg souris oral 300 mg/kg souris i. v. 538 mg/kg souris i. p. |
||
|
|
|||
Le diéthylstilbestrol (DES) est un œstrogène de synthèse. Il est synthétisé au Royaume-Uni en 1938, en premier lieu commercialisé comme médicament dans ce pays sous le nom de Stilbestrol-Limite, puis dans d'autres pays (dont la France) sous le nom de Distilbène.
Initialement prescrit par des médecins en 1938 aux femmes qui subissaient des avortements à répétition ou des accouchements prématurés, le DES fut alors reconnu comme un moyen sécuritaire de prévenir ces avortements à répétition et ces accouchements prématurés. Même si on trouva que les femmes enceintes auxquelles on donnait le DES avaient la même proportion de troubles que le groupe témoin, ce médicament continua à être promu, commercialisé et prescrit à grande échelle .
Dans les décennies qui ont suivi les premières prescriptions, un certain nombre d'anomalies génitales ont été rapportées chez les enfants nés de mères ayant pris du DES pendant leur grossesse (les "enfants DISTILBENE") : Chez les filles, dès la puberté, ont été rapportées des malformations génitales plus ou moins typiques, des risques augmentés de cancer du vagin (adénocarcinome à cellules claires du vagin), et de nombreux cas de stérilité. Chez les garçons, les effets sont moins visibles, mais il a été rapporté des cas de sténose de l'urètre, des kystes de l'épididyme, des malformations de l'urètre (hypospade), des testicules non descendus (cryptorchidie), et des cas d'hypotrophie testiculaire ainsi qu'une diminution de la qualité du sperme (oligospermie).
En 1971, aux États-Unis, la FDA met enfin l'embargo, et interdit la prescription de ce médicament chez les femmes enceintes. Le médicament a ensuite été interdit (chez les femmes enceintes) en 1976 par le Canada, en 1977 par la France, l'Allemagne, l'Autriche et les Pays-Bas, en 1978 par l'Australie, en 1981 par l'Italie et en 1983 par la Hongrie.
Mais "le mal était fait", et une génération d'enfants exposés au DES in utero est née entre 1940 et 1980.
L'âge de procréer, pour ces enfants, se situe en majeure partie entre 1975 et 2015 : Les problèmes génitaux mais aussi les problèmes de stérilité posés par ces enfants devenus adultes représentent un authentique problème de santé publique[2], [3]
Le DISTILBENE, qui n'a plus jamais été prescrit chez la femme enceinte depuis 1983, continue aujourd'hui d'être prescrit aux patients ayant des métastases de cancer de la prostate, où il a fait preuve de son efficacité.
Historique
Rappel des faits
Le diéthylstilbestrol (DISTILBENE, ou STILBESTROL-BORNE), œstrogène de synthèse non-stéroïdien, est synthétisé par E. G. DODDS[4] en 1938.
Il est en premier lieu prescrit, et ceci de manière particulièrement arbitraire, dans certaines grossesses à risque : Antécédents d'avortement spontané, hémorragies du premier trimestre de la grossesse. Puis chez les patientes diabétiques, dans la toxémie gravidique, et même dans le traitement de certaines stérilités inexpliquées...
En 1948, O. W. SMITH[5], [6] propose un traitement codifié par le DES dans l'ensemble des menaces d'avortement : Il propose des cures répétées à doses progressives de la 6e à la 35e semaine d'aménorrhée (SA), les posologies allant de 5 à 125 milligrammes par jour. Ce traitement est rapidement adopté par énormément d'obstétriciens.
En 1953 paraît dans l'American Journal of Obstetrics & Gynecology une étude de W. J. DIECKMANN[7] portant sur 840 patientes traitées par le DES contre un groupe témoin de 800 femmes, et montrant l'inefficacité du DES dans l'ensemble des indications pour lesquelles il est prescrit chez la femme enceinte. Cette étude passera néenmoins inaperçue.
Cependant, en 1970 et 1971 paraissent deux publications de A. L. HERBST[8], [9] qui attirent l'attention sur l'incidence nettement accrue de cancers du vagin d'un type spécifique (adénocarcinomes à cellules claires) chez les filles de mères ayant pris du DES lors de leur grossesse. Ce type de cancer étant jusque là exceptionnel dans la population générale. Le retentissement est immédiat aux États-Unis, et la Food and Drug Administration (FDA) interdit l'utilisation du produit dans ses indications obstétricales dès 1971.
Depuis, l'intérêt de la communauté scientifique pour les risques du DES chez la femme enceinte s'accroît. Et, mis à part l'adénocarcinome à cellules claires du vagin et les autres anomalies vaginales et cervicales, de multiples études, dont celles de Y. BRACKBILL en 1978 et de A. L. HERBST en 1981, révèlent les autres conséquences de l'exposition in utero au DES : malformations utérines, infertilité, grossesses extra-utérines, avortements spontanés tardifs, accouchements prématurés, et taux augmenté de morts néonatales... le "DES syndrome" était né !
La responsabilité du DES dans la genèse de ces différentes pathologies sera longtemps discutée, et elle le reste[10], [11]; étant donnés les importants biais statistiques qui entachent la majorité des études consacrées à ce sujet; mais certaines pathologies, comme les malformations génitales et l'infertilité, resteront indéniablement rattachées à ce produit.
Nombre de personnes atteintes
Le nombre exact de femmes enceintes ayant pris du DES n'est pas connu. Il est estimé à 4 millions aux États-Unis[12], 300 000 aux Pays-Bas, et 8 000 au Royaume-Uni[13]. En France, on estime ce chiffre à 200 000 femmes à peu près, sur une période de 25 ans (1951 à 1977, date de suppression des indications obstétricales du DES en France). En tenant compte des avortements et de la mortalité périnatale (20% des grossesses), 160.000 enfants sont nés dont 80.000 filles et 80.000 garçons[14]. L'âge de procréer, pour ces enfants, se situe en majeure partie entre 1975 et 2015. Le problème reste par conséquent d'actualité, ce qui a poussé les ministères de la santé de plusieurs pays à pratiquer des campagnes d'information ciblées sur ces "malades"[15], [16], [3].
Avec un recul d'environ 55 ans, on constate que le DES a été mis sur le marché sans aucune évaluation d'origine, et sans être breveté. Le risque tératogène n'a pas été pris en compte, et la mise en place d'un dispositif d'alarme a été trop longue[17]. L'exemple du DES souligne l'attention et la prudence qui doivent être de mise lors des prescriptions médicamenteuses, et surtout hormonales, chez la femme enceinte.
Les réactions dans le monde
Aux États-Unis
Interdit dès 1971, ce n'est qu'après que la Cour suprême a jugé incontestable la responsabilité du laboratoire, qu'un fonds d'indemnisation particulièrement dédié aux victimes du DES a été créé.
En France
Interdit en 1977, ce n'est qu'après quinze ans d'une longue bataille juridique, que la Cour de cassation a définitivement confirmé en mars 2006 la responsabilité du laboratoire UCB-Pharma pour avoir distribué ce médicament accusé d'avoir génèré des dizaines de milliers de cas de cancer, de malformations et de stérilité chez des jeunes femmes dont la mère avait reçu ce médicament. La Cour estime que le laboratoire a «manqué à son obligation de vigilance» étant donné qu'il était au courant qu'«existaient, avant 1971 et dès les années 1953-1954 des doutes portant sur l'innocuité du DISTILBENE (... ) et qu'en outre de nombreuses études expérimentales et des observations cliniques contre-indiquaient» son utilisation.
Une structure d'indemnisation pourrait prochainement être mise en place pour les 80 000 femmes françaises victimes. Mais selon, Anne Levadou, présidente du réseau DES-France[18] : «Ces femmes s'occupent en priorité de soigner leur cancer et gèrent de surcroît des grossesses complexes. Le poids d'une bataille devant les tribunaux les dissuade d'agir.» D'autant plus que l'action collective judiciaire est à l'état embryonnaire en France. Cependant, en juin 2005, le tribunal de Nanterre a accordé à huit femmes atteintes de cancers et de malformations de l'appareil génital, des réparations de 9 000 à 265 000 euros en dommages et intérêts.
Plus tard, la Cour de cassation renverse la charge de la preuve au profit de la victime. Dans un arrêt rendu le 24 septembre 2009[19], la Cour énonce : «après avoir constaté que le DES avait bien été la cause directe de la pathologie tumorale, partant que la victime avait été exposée in utero à la molécule litigieuse, de sorte qu'il appartenait alors à chacun des laboratoires mis en cause de prouver que son produit n'était pas à l'origine du dommage.»
Aux Pays-Bas
Interdit en 1977, un fond d'indemnisation a été créé .
Une étude néerlandaise parue en 2002 révèle que le DES continuerait à provoquer des malformations sur des petits garçons dont la grand-mère a été traitée.
Conséquences de l'exposition au DES in utero chez la fille
La totalité des anomalies génitales apparues chez les filles de mères ayant consommé du DES lors de leur grossesse a été décrit, dans le monde médical, sous le nom de "DES syndrome".
Le DES syndrome
Physiopathologie
L'exposition au DES peut entraîner, chez le fœtus de sexe féminin, deux types d'anomalies génitales : Des anomalies de l'épithélium cervical et vaginal (bénignes ou malignes), et des malformations utérines et tubaires. La physiopathologie de ces anomalies a principalement été étudiée sous son aspect clinique et épidémiologique, peu de travaux ayant été consacrés à l'expérimentation animale.
Embryologie du tractus génital féminin[20], [21]
Chez l'ensemble des fœtus humains (et ceci quel que soit leur «sexe génétique», c'est-à-dire leur génotype, avant la 9e semaine du DE, cœxistent deux types de structures : Les canaux de Müller, en nombre pair, qui donneront naissance (chez le fœtus de génotype 46, XX) à l'essentiel des organes génitaux féminins; et les canaux de Wolff, aussi en nombre pair, qui donneront naissance (chez le fœtus de génotype 46, XY) à l'essentiel des organes génitaux masculins. Rappelons schématiquement l'existence de 4 phases dans le développement du tractus génital féminin :
- De la 6e à la 8e semaine du développement embryonnaire (DE) :
Lors de cette première période, les canaux de Wolff (dits aussi canaux mésonéphrotiques) et les canaux de Müller (dits aussi canaux para-mésonéphrotiques) cœxistent. Les canaux de Müller étant chacun divisé en trois parties :
Une première partie (formée à la 6e semaine du D. E. ) supérieure (ou plus précisément «crâniale» pour utiliser le terme anatomique), verticale, s'ouvrant dans la cavité cœlomique (c'est-à-dire la future cavité péritonéale).
Une seconde partie (formée à la 7e semaine du DE) horizontale, qui croise le canal de Wolff homolatéral (c'est-à-dire du même côté).
Une troisième partie (formée à la 8e semaine du DE) inférieure (ou plus précisément «caudale» pour utiliser le terme anatomique), verticale, qui est conçue pour fusionner avec son homologue controlatérale (c'est-à-dire de l'autre côté) pour donner naissance au «canal utéro-vaginal».
NB : Les deux premières parties du canal de Müller donneront naissance aux trompes, tandis que le «canal utéro-vaginal» donnera l'utérus.
- De la 9e à la 10e semaine du DE :
Les parties «caudales» (inférieures) des canaux de Müller vont fusionner (donnant ainsi naissance au «canal utéro-vaginal», toujours barré, à ce stade, par la «cloison intermüllerienne» en son milieu) ; et les canaux de Wolff commencent leur régression.
- De la 11e à la 13e semaine du DE :
La "cloison intermüllerienne" va se résorber, débutant ainsi la formation de l'utérus (qui se poursuivra jusqu'à la 16e semaine du D. E. ). Et les canaux de Wolff poursuivent leur régression, en ne laissant finalement que deux vestiges inconstants : L'époophore (à proximité du pavillon de la trompe, et l'organe de Gärtner (dans la partie inférieure de la paroi vaginale).
- De la 14e à la 20e semaine du DE :
Le vagin va se former. Deux théories existent sur la formation du vagin :
Une théorie «sinusale» : Selon cette théorie, le vagin se forme par évidement de la «plaque vaginale» (issue de la confluence des «bulbes sino-vaginaux», nés eux-mêmes du «sinus uro-génital»).
Une théorie «sinuso-müllerienne» : Selon cette théorie, le vagin aurait une origine double : les 4/5èmes supérieurs proviendraient du «canal utéro-vaginal» (dont on a vu qu'il provenait lui-même de la fusion des partie «caudales» (inférieures) des canaux de Müller), et le 1/5e inférieur serait issu du «sinus uro-génital».
Quoi qu'il en soit, toute cette phase du développement embryonnaire (de la 6e à la 20e semaine du DE) est étroitement soumise à des facteurs hormonaux, et surtout à l'influence des œstrogènes.
Expérimentation animale
Les animaux étudiés sont la souris, le rat, le hamster, et le macaque. [22], [23], [24], [25] Les lésions bénignes décrites dans l'espèce humaine sont retrouvées chez l'ensemble des animaux étudiés, tandis que le cancer à cellules claires du vagin n'est retrouvé que chez la souris. [26]
- Les anomalies cervicales et vaginales :
Les études chez l'animal confirment la fréquence de l'adénose (ce terme sera explicité plus loin dans cet article) et des autres anomalies cervicales et vaginales. [27] Trois actions du DES ont été individualisées :
- Le DES stimule la croissance des microvillosités des cellules épithéliales. [28], [29]
- Le DES déplace la zone de jonction squamo-cylindrique (c'est-à-dire la zone où se rencontrent l'épithélium malpighien et l'épithélium glandulaire au niveau du col utérin) vers le vagin. [30]
- Le DES entraîne une métaplasie utérine des cellules claires. [31]
- Les modifications utérines :
Elles sont aussi retrouvées chez l'animal [22], [29], et restent complexes à expliquer. Une étude menée par R. WORDINGER [29] en 1991 montrait l'existence, chez la souris exposée au DES, d'une hypertrophie des cellules épithéliales superficielles de la cavité utérine, ainsi qu'une formation prématurée des glandes utérines au cours de la première semaine de vie. Il est à noter qu'aucune étude expérimentale n'a été consacrée à l'action du DES sur la vascularisation utérine.
Effets du DES in vitro
La toxicité du DES (et surtout son action cancérigène, qui a été démontrée in vitro) serait due à son action ou à celles de ses métabolites [32], [33] sur le matériel génétique des cellules cibles [32], [34], [35], [36] : Echanges de chromatine, anomalies de synthèse de l'ADN, aberrations chromosomiques... Des modifications enzymatiques ont aussi été mises en évidence, pouvant expliquer les anomalies fonctionnelles (incompétence cervicale, anomalies tubaires).
Hypothèses proposées
- Hypothèse «corporéale» [37] :
L'action du DES serait conjointe sur les canaux de Müller et de Wolff. Sachant que ces deux structures cœxistent chez l'embryon au stade indifférencié, et sont positionnées dans un mésenchyme commun qui les solidarise l'une à l'autre. "Si on tient compte du fait que les canaux de Wolff sont toujours généralement trouvés chez les embryons au stade de 70mm, c'est-à-dire entre 3 et 4 mois, on peut comprendre les modifications de l'utérus des fillettes au DES. Tandis que les canaux de Müller se développent normalement (ou, peut-être même, sont-ils soumis à une certaine stimulation), la régression excessive des canaux de Wolff sous l'effet du DES oblige les canaux de Müller à subir une incurvation ainsi qu'à diverger horizontalement l'un comparé à l'autre. Cette divergence horizontale serait à l'origine de l'aspect en T, alors que l'incurvation vers l'intérieur de chacun des canaux de Müller rendrait compte du rétrécissement de la cavité corporéale visible au dessous des cornes et peut-être de la dilatation en forme de bulbe sus-isthmique". Cette hypothèse a le mérite d'expliquer les malformations de la cavité utérine, mais ne donne pas d'explication aux anomalies cervicales et vaginales, et surtout au déplacement de la zone de jonction (zone de rencontre entre l'épithélium malpighien et l'épithélium glandulaire sur le col de l'utérus) vers le vagin.
- Hypothèse «cervicale» [38] :
Cette hypothèse, au contraire de la précédente, a le mérite d'expliquer l'ensemble des anomalies bénignes dues au DES. Selon H. N. MINH, partisan de la théorie sinusale pure de l'embryogenèse vaginale, c'est le développement exagéré de la portion caudale des canaux de Müller (qui donnera naissance au canal utéro-vaginal) qui expliquerait à la fois les anomalies cervicales et les anomalies corporéales (anomalies du corps de l'utérus). Ainsi, cette hypertrophie de la portion caudale des canaux de Müller déterminerait le blocage de la montée de la plaque vaginale (et par conséquent le déplacement de la zone de jonction vers le vagin), et l'absence de modelage du col utérin (ce qui expliquerait les nombreuses anomalies de forme du col). Mais également, cette hypertrophie des portions caudales refoulerait les portions moyennes des canaux de Müller vers le haut. Or, ces portions moyennes, «retenues par le mésenchyme du mésentère postérieur et par leur attachement aux ligaments inguinaux», sont contraintes de diverger horizontalement (ce qui explique la forme en T de ces utérus, mais également leur petite taille (hypoplasie) ).
Effets dose et effets temps
- Effets dose :
La posologie préconisée par O. W. SMITH[39] prévoyait une dose de 5 mg par jour à partir de 6 semaines de grossesse avec une augmentation de 5 mg par jour l'ensemble des 15 jours jusqu'à 25 mg par jour puis une augmentation de 5 mg l'ensemble des semaines jusqu'à la 33e semaine de grossesse. Ce schéma pseudo-scientifique n'a pas forcément été suivi; certaines patientes n'ayant été «traitées» qu'au 2e trimestre de leur grossesse. Il est par conséquent quasiment impossible actuellement de connaître les doses prises par les mères de patientes DES. Il semblerait cependant que les effets aient été les mêmes en cas de dose moindre que celle préconisée par O. W. SMITH[40] Cependant, aucun auteur n'a aujourd'hui pu étudier l'effet dose.
- Effets temps :
Selon que la mère ait pris du DES avant la 12e semaine de grossesse, entre 13 et 18 semaines, ou après 19 semaines, on constate un taux décroissant des anomalies dues au DES, comme l'a montré R. H. KAUFMAN[41], et comme le montre le tableau ci-dessous, tiré du travail du Collège national des gynécologues et obstétriciens français[42] :
| Début d'exposition | Anomalies de l'utérus | Anomalies du col | Adénose vaginale |
|---|---|---|---|
| Avant 12 semaines | 71% | 75% | 64% |
| 13 à 18 semaines | 62% | 62% | 87% |
| Après 19 semaines | 40% | 40% | 20% |
En réalité, les choses sont moins simples :
- Dans le groupe exposé avant 12 semaines, KAUFMAN compare 8 patientes présentant une hystérosalpingographie normale (ces patientes ont des anomalies du col dans 2 cas et une adénose (ce terme sera expliqué plus loin dans cet exposé) dans 4 cas) et 20 patientes présentant une hystérosalpingographie anormale (il n'y a alors pas d'anomalie cervicale dans un cas et pas d'adénose dans 6 cas). KAUFMAN en conclut que les organes génitaux ne se comportent pas obligatoirement comme des organes cibles vis-à-vis du DES avant la formation définitive de l'utérus.
- 40% des malformations utérines sont observées dans le groupe exposé après 19 semaines (tandis que l'utérus est constitué). KAUFMAN en conclut que le DES peut agir sur le développement de l'utérus déjà constitué.
En conclusion, on peut particulièrement schématiquement retenir trois types d'action du DES sur les tissus cibles :
- Action carcinogène et mutagène sur le génome.
- Modifications enzymatiques certainement responsables d'anomalies fonctionnelles.
- Modifications de structure des épithéliums, et des canaux de Müller et de Wolff.
Les anomalies cervico-vaginales
L'adénose cervico-vaginale
L'adénose cervico-vaginale est définie par la présence anormale d'un épithélium glandulaire (dit "ectopique") sur l'exocol et sur le vagin, mais aussi par des anomalies de structure du col et du vagin souvent associées.
Elle est estimée à 30% des sujets exposés (soit à peu près 60.000 femmes en France), et atteindrait 60% des sujets quand il existe des symptômes liés à cette adénose. Le risque d'adénose semble lié principalement à la précocité du traitement par le DES, plus qu'à la durée, comme l'a montré A. L. HERBST[43] qui trouve une action néfaste du DES quand il a été prescrit entre 6 et 17 semaines de grossesse, tandis qu'il ne retrouve pas d'adénose quand la prescription a été faite après 18 semaines (au contraire de R. H. KAUFMAN[41] qui trouve 20% d'adénose après 18 semaines).
- Causes :
Elles restent controversées, par le fait même qu'il existe toujours des controverses quant à l'embryogenèse du vagin. Il semblerait que la théorie mixte sinuso-müllerienne (selon laquelle les 4/5èmes supérieurs du vagin seraient tapissés d'un épithélium glandulaire müllerien, dérivant du canal utéro-vaginal, et le 1/5e inférieur d'un épithélium malpighien sinusal, dérivant du sinus uro-génital) soit de moins en moins admise. C'est aujourd'hui la théorie uniciste sinusale pure qui prévaut[38]. Selon cette théorie, tout le vagin et la partie intravaginale du col sont tapissés d'un épithélium malpighien sinusal. Il existerait, sous l'influence du DES, une fluctuation de la ligne de démarcation sinuso-müllerienne. L'épithélium malpighien sinusal serait repoussé par l'épithélium glandulaire de l'endocol qui "coloniserait" alors beaucoup l'exocol et une partie plus ou moindre du vagin.
Clinique et colposcopique :
L'adénose ne donne le plus souvent pas de symptômes, mais elle peut se révéler par des leucorrhées ou par des métrorragies. Elle siège sur le col et le vagin à son tiers supérieur, particulièrement rarement dans ses deux tiers inférieurs. Deux formes ont été décrites :
- Les formes glandulaires pures :
Ces formes sont rarement observées (ceci est dû à la réparation métaplasique qui commence particulièrement tôt au niveau du vagin). Ces formes siègent au niveau du col ("ectropion congénital") et du fond vaginal. En colposcopie, l'adénose se traduit par une zone rouge, étendue, d'aspect mamelonné; qui se colore en blanc après application d'acide acétique tout en gardant une bordure nette; et qui ne se colore pas par l'application d'iode concentré (Lugol).
- Les formes glandulaires remaniées :
De loin les plus habituelles, elles forment en fait un mode d'évolution de l'adénose. Les aspects sont variables selon la nature et la progression du processus de réparation métaplasique, qui évolue de manière centripète. Cette réparation va se traduire par une coloration blanche après application d'acide acétique, dont les contours sont idéalement nets, réalisant une zone de "transformation atypique de grade 1" selon l'expression colposcopique. À terme, cette zone peut se transformer en un épithélium malpighien, ou évoluer vers une kératose.
La présence, au frottis, de cellules glandulaires et de cellules métaplasiques, avec ou sans goutelettes de mucus intra-cytoplasmiques, est évocatrice d'une adénose[44]. (En excluant, évidemment, une contamination par des cellules de l'endocol).
La biopsie n'est pas indispensable au diagnostic. Elle pourra quelquefois même être trompeuse en surévaluant la gravité des lésions. (Elle devient cependant indispensable en cas d'anomalies cytologiques et de colposcopie suspecte). Si elle est réalisée, elle confirmera facilement le diagnostic.
- Evolution :
Régression :
C'est une évolution fréquente. Le pourcentage de régression variant, selon les auteurs, entre 29%[45] et 75%[46], et ceci de 3 à 5 ans après le diagnostic d'origine. La disparition complète de l'adénose est aussi envisageable dans 32% des cas, 4 à 5 ans après le diagnostic initial[47], [46].
Risque de dysplasie :
Les résultats des études consacrées à ce sujet sont assez discordants, mais il semblerait que les dysplasies du col de l'utérus et du vagin soient plus habituelles chez les patientes DES. S. J. ROBBOY, en 1981[48], a étudié 4589 patientes par cytologie du col de l'utérus, et a retrouvé 1, 8% de dysplasies (pourcentage significativement non différent de celui de la population témoin). Tandis que N. C. FOWLER, la même année[49], étudiant 325 patientes par colposcopie et biopsie, trouve 16, 2% de dysplasies. Ce qui sera confirmé par S. J. ROBBOY en 1984[50], dans une étude portant sur 3980 patientes (par colposcopie et histologie), où il retrouve 15, 7% de dysplasies contre 7, 9% chez les témoins. Ces discordances peuvent peut-être s'expliquer par l'échantillonnage des patientes dans les différentes études, mais également par l'âge des patientes au moment de l'étude[51], [52]. De plus, l'adénose semble être un facteur prédisposant à l'infection par les Papillomavirus humains[53], comme l'a montré J. BORNSTEIN en 1987[54], qui retrouve l'HPV16 dans le génome des cellules atypiques des cinq femmes ayant développé une dysplasie du vagin tandis qu'elles étaient surveillées dans le cadre de l'étude.
Risque d'adénocarcinome à cellules claires ?
L'hypothèse d'une filiation entre l'adénose et l'adénocarcinome à cellules claires du vagin a maintes fois été soulevée, surtout par S. J. ROBBOY en 1984. Aucune étude n'a, jusqu'désormais, établi un lien formel entre ces deux anomalies, et la différence de fréquence (30% pour l'adénose contre 1/1000 pour l'adénocarcinome à cellules claires) ne plaide pas en faveur de cette filiation. La question, à ce jour, reste posée...
- Conduite à tenir :
À cause de l'évolution spontanément favorable de l'adénose, une simple surveillance annuelle, par cytologie et colposcopie, est conseillée. En gardant à l'esprit le risque accru de dysplasie (ce qui conduira à pratiquer des biopsies au moindre doute) [51], [52], [55]. Le traitement est principalement local, au cas par cas, faisant appel aux anti-infectieux ainsi qu'aux trophiques locaux en cas de contraception par pilule. Il faut s'abstenir de tout traitement physique (électrocoagulation, cryothérapie, LASER), qui pourrait entraîner une sclérose du col de l'utérus, voie une sténose (rétrécissement anormal), sans pour tout autant diminuer le risque de dysplasie[51], [52].
Les anomalies cervico-vaginales structurales
Il s'agit d'anomalies anatomiques touchant l'aspect même du col de l'utérus ou du vagin.
Selon les auteurs[56], [57], [52], ces anomalies seraient observées chez 22 à 58% des patientes exposées, elles peuvent être associées à l'adénose, ou isolées, en cas d'exposition plus tardive à partir de 20 semaines de grossesse.
Différents aspects ont été décrits[52] :
- Hypoplasie du col de l'utérus, avec un aspect de petit col conique.
- "Cervico-vaginal hood" (sillon circulaire séparant la partie interne du col et une collerette périphérique de col utérin.
- Aspect en "casquette d'aviateur" (protubérance de la berge antérieure du col utérin.
- Crêtes transversales crénelées du col.
- Aspect de pseudo-polype du col.
- Déformations de l'orifice du col en "S", en "T", ou en "Y".
- Présence d'un diaphragme vaginal partiel (repli du vagin cachant une partie latérale du col).
- Présence d'un diaphragme vaginal circulaire («coiffant» le col en périphérie).
- Présence d'un bourrelet vaginal.
Ces lésions structurales ont tendance à régresser spontanément, ou alors à disparaître avec le temps, mais le délai serait plus long que pour l'adénose : D. A. ANTONIOLI[58] observe un effacement partiel du "hood" dans 52, 8% des cas et une disparition dans 28% des cas. Et A. L. HERBST[59], qui observait 56% de crêtes transversales chez 338 patientes DES, n'en retrouve que 24% quatre ans plus tard.
Quoi qu'il en soit, ces lésions ne semblent pas avoir de conséquences fâcheuses en elles-mêmes, et il n'est , généralement, proposé aucun traitement.
L'adénocarcinome à cellules claires (ACC) du vagin
- Rôle du DES / Epidémiologie[60], [61] :
C'est en 1970 que A. L. HERBST[62] suggère le rôle du DES dans la genèse de l'adénocarcinome à cellules claires (ACC) du vagin, dans une étude cas-témoin portant sur 8 cas d'ACC appariés à 32 cas témoins. 7 patientes sur 8 avaient été exposées in utero au DES. Un registre des observations d'ACC est mis en place dès 1972, et les cas enregistrés ont été colligés par A. L. HERBST et son équipe[63]. Le nombre de cas enregistrés a augmenté jusqu'en 1975, et s'est mis à décliner ensuite. Cette évolution est parallèle, avec un décalage de 20 ans, à celle des ventes de DES[51], [64]. L'âge moyen des patientes, en 1991, est de 20 ans, avec des extrêmes allant de 7 à 34 ans. Ce registre comprenait, en 1991, près de 600 cas dont les deux tiers sont apparus chez des patientes DES. En effet, en 1987, A. L. HERBST publie une mise à jour sur 519 patientes : Dans 60% des cas, il existait une preuve de l'exposition au DES, et dans 12% des cas, d'autres hormones avaient aussi été prescrites au cours de la grossesse (œstrogènes et/ou progestatifs). Dans 30% des cas, aucun traitement hormonal n'avait été prescrit. D'autres études ont, depuis, conforté l'hypothèse du rôle du DES (ne fût-ce que comme co-facteur) dans la responsabilité des ACC, comme le montrent J. R. DELPERO[60] et D. DARGENT[51], [65].
Le tableau ci-dessous (d'après DELPERO) montre le nombre de malades porteuses d'un ACC (selon trois études), selon que leurs mères aient pris ou non du DES pendant leur grossesse :
| Auteur | Exposées au DES | Non-exposées au DES |
|---|---|---|
| HERBST | 7 | 1 |
| GREENWALD | 6 | 0 |
| HENDERSON | 6 | 1 |
Le risque de survenue d'un ACC est estimé à 1/1000 à peu près chez les patientes DES[66], [67], [60]. Sachant que le nombre de ces femmes est estimé à 1 700 000 aux États-Unis, 1 700 ACC sont "attendus" dans ce pays jusqu'en 2010. En France, le nombre des patientes DES est estimé à 80.000 (ce qui est certainement une sous-estimation), on "attend" par conséquent au moins 80 ACC jusqu'en 2010 (sachant qu'en 1991, 30 cas à peu près avaient été répertoriés).
Il existe, sommairement, 4 types de cancers du vagin :
- Les carcinomes épidermoïdes (ou malpighiens) : 90% à peu près.
- Les adénocarcinomes : 9% à peu près (3 types d'adénocarcinomes du vagin sont décrits : A cellules cylindriques, endométrioïdes, ainsi qu'à cellules claires (ACC).
- Les sarcomes : Moins de 2%.
- Les cancers rares (tumeurs embryonnaires, mélanomes malins... ).
Les ACC peuvent, eux-mêmes, se présenter sous 4 formes différentes :
- ACC à composante solide.
- ACC à composante papillaire.
- ACC à composante tubulo-cystique.
- Formes combinées.
Il semblerait que le pronostic soit meilleur pour les formes tubulo-cystiques que pour les trois autres formes, et ceci de façon statistiquement significative[68].
- Clinique :
Le diagnostic est évoqué devant la naissance de métrorragies ou de leucorrhées sans caractère spécifique, quelquefois aussi devant la naissance récente de dyspareunies (douleurs pendant les rapports sexuels), mais ce diagnostic est porté dans 20% des cas lors de la surveillance systématique des patientes DES. L'âge moyen au moment du diagnostic est de 20 ans. L'ACC se présente classiquement sous la forme d'une tumeur du tiers supérieur du vagin, à sa face postérieure (mais d'autres localisations sont envisageables), débordant dans 50% des cas sur le col. Dans les tumeurs volumineuses, plusieurs localisations peuvent cœxister (on parle alors de tumeur multifocale). La propagation des cellules tumorales sous la muqueuse du vagin est fréquente. Le volume fluctue de tumeurs microscopiques à des masses dépassant les 10 cm de diamètre, d'aspect polypoïde (ressemblant à un polype) et nodulaire, mais quelquefois plates (on parle alors de tumeurs planes) ou ulcérées. Elles peuvent occasionnellementêtre invisibles en colposcopie. Leur infiltration en profondeur est , le plus souvent, limitée. Le diagnostic des ACC se fait, dans 70% des cas, à un stade débutant (stade I), contre moins de 10% à un stade avancé (stade III et IV) (Voir tableau de la classification de la Fédération Mondiale des Gynécologues-Obstétriciens (FIGO) des cancers du vagin[69] ci-dessous). Malheureusement, 15 à 20% des stades I et 30 à 50% des stades II présentent déjà des métastases dans les ganglions lymphatiques.
| Stade FIGO | Description |
|---|---|
| 0 | Carcinome pré-invasif (carcinome in situ) |
| I | Tumeur limitée à la paroi du vagin |
| II | Tumeur atteignant les tissus sous-vaginaux ("paravagin") mais sans s'étendre à la paroi du pelvis :
Subdivisée en IIa (sans envahissement des ligaments du col utérin ("paramètre") ), et IIb (avec envahissement des ligaments du col utérin ("paramètre") ). |
| III | Tumeur s'étendant à la paroi du pelvis. |
| IVa | Tumeur s'étendant à la muqueuse de la vessie et/ou du rectum, et/ou s'étendant au delà du pelvis. |
| IVb | Dissémination dans des organes éloignés (métastases). |
Les ACC chez les patientes DES se définissent par un pronostic le plus souvent favorable[72], [73] : 80% de rémission à 5 ans, tous stades confindus, et 90% pour les stades I. Ce bon pronostic autorise, dans la mesure du possible, un traitement visant à sauvegarder les ovaires et leur fonction, mais aussi l'utérus et la fonction de reproduction.
Longtemps exclusivement chirurgical (basé sur une ablation de l'utérus de son col, de ses ligaments, et de la partie supérieure du vagin ("colpohystérectomie élargie") associée à une ablation des ganglions lymphatiques du pelvis) ; le traitement des ACC a bénéficié de plus en plus des progrès de la radiothérapie.
Le protocole proposé par la FIGO, pour les stades I à III, est le suivant : Laparotomie exploratrice pour pratiquer l'évaluation des ganglions lymphatiques, et pour pratiquer une transposition ovarienne (déplacement des ovaires plus haut que le pelvis, afin d'éviter leur irradiation au moment de la radiothérapie) :
- En l'absence d'atteinte des ganglions lymphatiques : curiethérapie du col et du vagin par un «moule» intra-vaginal adapté à la forme de la lésion.
- En cas d'atteinte des ganglions lymphatiques : Radiothérapie externe du pelvis (à la dose de 40 à 50 grays; puis curiethérapie complémentaire pour obtenir la stérilisation complète de la tumeur.
- S'il existe des métastases dans d'autres organes : chimiothérapie.
Le traitement chirurgical d'ablation utérine et/ou vaginale est réservé aux rechutes secondaires.
Évidemment, certains cas sont toujours susceptibles de relever d'un traitement chirurgical premier ou exclusif. Cette chirurgie est plus ou moins étendue selon le stade de la tumeur, avec des possibilités ultérieures de reconstruction du vagin par diverses techniques.
Les taux de survie à 5 ans, selon le stade, sont les suivants[70] : 88 à 90% pour les stades I; 76% pour les stades II; 30% pour les stades III; et 20% pour les stades IV.
Les rechutes se voient principalement dans les trois premières années après le traitement, leur fréquence est estimée à 28%, et plus de la moitié de ces rechutes surviennent sur le vagin ou dans le pelvis.
Deux facteurs conditionnent le pronostic des ACC du vagin : Le stade de la tumeur au moment du diagnostic, et le statut des ganglions lymphatiques (envahis, ou non envahis).
Les anomalies utéro-annexielles
Dès 1977, R. H. KAUFMAN attire l'attention sur les lésions utérines des femmes exposées au DES in utero[41]. D'autres études parues depuis viendront conforter cette hypothèse. En 1981, A. H. DECHERNEY[74] décrit des anomalies tubaires chez ces femmes, pouvant expliquer la survenue d'une stérilité ou d'une grossesse extra-utérine.
Les anomalies utérines
- Fréquence :
Leur fréquence est estimée à 70% des femmes exposées in utero au DES, selon R. H. KAUFMAN, selon l'observation de 267 hystérographies[75]. Il semblerait que le risque d'anomalies utérines soit lié à la précocité du traitement par le DES, et non à la dose totale absorbée par la mère, comme l'a démontré R. H. KAUFMAN[41] qui trouve 73% d'anomalies utérines quand l'exposition au DES a débuté avant avant la 12e semaine de grossesse, 66% quand le produit a été administré entre 13 et 18 semaines, et 45% après la 19e semaine. Ces anomalies utérines sont plus souvent rencontrées en cas d'anomalies du col et du vagin (voir tableau ci-dessous (d'après B. BLANC) ), comme l'a démontré R. H. KAUFMAN[76], mais 50% d'entre elles restent isolées[77].
| Anomalies du vagin | Pas d'anomalies du vagin | Anomalies du col | Pas d'anomalies du col | |
|---|---|---|---|---|
| Anomalies utérines (%) | 82% | 44% | 86% | 56% |
Pour plus de clarté, ce chapitre traite scindément les anomalies de taille (hypoplasie utérine) et les anomalies de forme (malformations utérines imputables au DES), sachant qu'elles sont le plus fréquemment associées. "L'incompétence" du col de l'utérus sera traitée, elle , dans le chapitre concernant l'évolution des grossesses.
- Anomalies de taille : L'hypoplasie utérine.
L'hypoplasie utérine se définit classiquement par une distance entre les deux cornes utérines inférieure à 4 cm et une inversion du rapport "longueur du corps utérin / longueur du col de l'utérus" (qui est normalement supérieur à 1). Ces deux paramètres étant mesurables par l'hystérographie, par l'échographie, ou par l'IRM. Dans les cas extrêmes, on parle d'hypotrophie de l'utérus (distance entre l'orifice interne du col de l'utérus et le fond utérin inférieure à 2, 5 cm).
La fréquence de cette "petitesse" utérine due au DES est diversement appréciée par les études : 44% des femmes exposées selon A. CABAU, et 9% uniquement pour R. H. KAUFMAN[41], mais ses caractéristiques sont spécifiques. En effet, A. HANEY[78] a montré que seule la distance "orifice interne du col - fond de la cavité utérine" était diminuée, tandis que la distance entre les deux cornes utérines était égale ou supérieure à 4 cm, c'est-à-dire comparable à celle des utérus normaux (ceci pouvant s'expliquer par l'aspect de l'utérus "en T" fréquemment rencontré chez les femmes exposées au DES). Il en conclut que la surface totale de l'endomètre (muqueuse de l'utérus) n'est pas diminuée chez ces femmes, comparé aux femmes ayant un utérus normal. Curieusement, une étude de P. P. HORNSBY[79] concernant les effets du DES sur le cycle menstruel et portant sur 542 patientes montrait une durée des règles écourtée d'un jour et demi en moyenne comparé à la population générale, ainsi qu'une abondance moyenne du flux menstruel diminuée (sans que des anomalies du cycle aient été notées). Cette diminution du flux menstruel, qui semble tout de même à mettre sur le compte d'une diminution de la surface de l'endomètre, est aussi retrouvée par L. COUSINS[80].
G. N. VISCOMI[81], en 1980, a été le premier à pratiquer une étude échographique des "utérus DES" chez 18 femmes exposées au DES (comparées à un groupe témoin de 20 femmes non exposées). Il a mesuré, pour chaque femme, le longueur de l'utérus (L), sa largeur (W), et et son épaisseur (D) ; ce qui lui a permis de calculer le volume utérin global par la formule : V = 4/3π x L/2 x D/2 x W/2. L'ensemble des paramètres mesurés (longueur, largeur, et épaisseur utérine) mais aussi le volume utérin calculé étaient significativement diminués dans le groupe des femmes exposées au DES (voir tableau ci-dessous).
| Groupe "normal" (n=20) | Groupe DES (n = 18) | |
|---|---|---|
| Longueur utérine | 8, 1 cm +/- 0, 77 | 6, 8 cm +/- 0, 4 |
| Largeur utérine | 5, 1 cm +/- 2, 75 | 4, 6 cm +/- 1, 9 |
| Epaisseur utérine | 4, 3 cm +/- 1, 10 | 3, 1 cm +/- 0, 6 |
| Volume utérin | 90cm3 +/- 22 | 49, 4cm3 +/- 25, 5 |
Toutes ces données amènent à certaines conclusions concernant la «petitesse» utérine due au DES : Le volume utérin global est réduit, aux dépens du corps de l'utérus (inversion du rapport "corps / col") ; mais la surface de la cavité utérine ne serait pas réduite (bien que ce sujet prête toujours à discussion).
- Anomalies de forme : Les malformations utérines imputables au DES.
Plusieurs types de malformations utérines ont été décrites dans la littérature médicale[82], [83], [84], [41], [85], [86]. Leur physiopathologie n'est que partiellement comprise, reposant principalement sur des anomalies de la fusion des canaux de Müller. Leur fréquence est diversement appréciée selon les auteurs (69% des femmes exposées, selon KAUFMAN (hypoplasie comprise) ).
Les malformations les plus souvent retrouvées sont les suivantes :
- Utérus "en T".
- Dilatation de l'utérus au dessus de l'isthme, avec aspect rétréci de l'isthme.
- Distension des cornes utérines, en forme de "bulbe".
- Aspect rétréci, annulaire, des cornes utérines.
- Aspect irrégulier, "tourmenté", des bords de la cavité utérine.
- Utérus bicorne bicervical.
- Présence de synéchies des bords de la cavité utérine.
- Associations :
Le plus fréquemment, diverses anomalies sont associées sur le même utérus. La fréquence de ces associations, diversement appréciée selon les auteurs, est rapportée ici à titre d'exemple [87], [85], [88] :
- Utérus "en T" avec hypoplasie : 31%.
- Utérus "en T" isolé : 19 à 50%.
- Hypoplasie isolée : 13%.
- Utérus "en T" avec rétrécissement de l'isthme, dilatation au dessus de l'isthme, aspect irrégulier des bords, distension des cornes utérines, rétrécissement des cornes utérines : 13 à 33%.
- Rétrécissement de l'isthme isolé : 4 à 11%.
- Autres : 4%.
Les anomalies annexielles
- Anomalies tubaires :
DECHERNEY[89] a décrit chez 16 femmes DES des anomalies de la partie distale de la trompe : Paroi amincie, hypoplasie du pavillon, phimosis. BELAÏSCH[90] rapporte des aspects spécifiques en hystérosalpingographie : Trompes "étirées" vers le bas (comme si une traction s'était effectuée au cours de la vie embryonnaire). Ces anomalies pourraient être à l'origine de grossesses extra-utérines.
- Autres anomalies annexielles :
Une plus grande fréquence des infections génitales hautes (salpingites) chez les femmes DES a été rapportée par HERBST.
Les conséquences sur la fonction de reproduction
Les multiples anomalies portant sur l'appareil génital chez les femmes exposées au DES in utero vont se manifester principalement par leurs conséquences sur la fertilité et le déroulement des grossesses. Ce sont ces conséquences qui, le plus fréquemment, vont amener la femme à consulter un gynécologue.
Conséquences sur la fertilité
Prévalence de la stérilité chez les femmes DES
Il est aujourd'hui bien établi que les femmes exposées in utero au DES ont un taux de stérilité plus élevé que dans la population générale. BIBBO, en 1977, rapportait un taux de 18% de grossesses chez les femmes DES, contre 33% chez les femmes non exposées. Cette constatation est confirmée par HERBST[91] en 1981 : 75% de grossesses chez les femmes DES contre 92% dans la population non exposée. Enfin, SENEKJIAN[92], en 1988, a mené une étude incluant 408 femmes exposées contre 388 femmes non exposées, en comparant les taux de stérilité primaire et secondaire. Les résultats sont résumés dans le tableau qui suit :
| Exposées au DES | Non exposées au DES | |
|---|---|---|
| Stérilité primaire | 33% | 14% |
| Stérilité secondaire | 23% | 15% |
Les facteurs associés à la stérilité chez les femmes DES
- Facteur utérin :
C'est le premier facteur étudié. L'étude la plus complète sur le sujet semble avoir été celle de R. H. KAUFMAN[93] en 1986, qui incluait 632 patientes DES : 16 de ces femmes n'avaient aucune activité sexuelle, et n'ont pas eu d'hystérosalpingographie, et 616 avaient une activité sexuelle régulière : 367 d'entre elles n'avaient aucune contraception et envisageaient une grossesse. Ces 367 femmes ont toutes eu une hystérosalpingographie et ont toutes tenté de d'obtenir une grossesse pendant au moins un an. Certaines ont été suivies pendant trois ans. Les deux tableaux qui suivent résument les résultats de cette étude.
| Hystérosalpingographie NORMALE | Hystérosalpingographie ANORMALE | TOTAL | |
|---|---|---|---|
| Nombre de femmes (et %) | 97 (26%) | 270 (74%) | 367 (100%) |
| Ont tenté une grossesse pendant un an maximum | |||
| Ont obtenu une grossesse | 59 (61%) * | 167 (62%) * | 226 (62%) * |
| N'ont pas obtenu de grossesse | 2 (2%) * | 5 (2%) * | 7 (2%) * |
| Ont eu une difficulté à concevoir qui plus est d'un an | 36 (37%) * | 98 (36%) * | 134 (36%) * |
| Ont obtenu une grossesse | 21 (58%) # | 55 (56%) # | 76 (57%) # |
| Entre 1 et 3 ans | 16 (76%) § | 25 (45%) § | 41 (54%) § |
| Après 3 ans | 5 (24%) § | 30 (55%) § | 35 (46%) § |
| N'ont pas obtenu de grossesse | 15 (42%) # | 43 (44%) # | 58 (43%) # |
| Ont essayé 1 à 3 ans | 9 (60%) ° | 24 (56%) ° | 33 (57%) ° |
| Ont essayé plus de 3 ans | 6 (40%) ° | 19 (44%) ° | 25 (43%) ° |
(*) = Pourcentage des femmes étudiées. (#) = Pourcentage des femmes ayant eu des difficultés à concevoir (de plus d'un an). (§) = Pourcentage des femmes ayant eu des difficultés à concevoir mais ayant obtenu une grossesse. (°) = Pourcentage des femmes ayant eu des difficultés à concevoir mais n'ayant pas obtenu de grossesse.
Cette première série de résultats suggère que la présence d'une anomalie utérine n'est pas un facteur contribuant à la stérilité. Le nombre de femmes avec une hystérosalpingographie normale et avec une hystérosalpingographie anormale qui ont eu des difficultés à concevoir est le même. Et vice versa, chez les femmes ayant eu des difficultés à concevoir, la fréquence des hystérosalpingographies normales et anormales est la même.
L'étude s'intéresse alors aux relations existant entre la difficulté à concevoir et les types de malformations retrouvées à l'hystérosalpingographie :
| Fréquence (%) | Hystérosalpingographie | Risque relatif |
|---|---|---|
| Anormale (Toutes anomalies confondues) | 1, 02 | |
| 50 | Utérus "en T" | 1, 49 |
| 26 | Rétrécissement au dessus de l'isthme utérin | 2, 26 |
| 22 | Utérus «en T» avec rétrécissement au dessus de l'isthme utérin | 2, 63 |
Cette deuxième série de résultats montre que le présence d'un rétrécissement au dessus de l'isthme utérin, mais aussi la présence d'un utérus «en T» avec rétrécissement au dessus de l'isthme utérin, semblent liées à une plus grande fréquence de stérilités.
Ces données ont été confirmées par d'autres publications. L. BOUBLI[94], par exemple, rapporte une fréquence de 46% de grossesses chez les femmes avec une hystérosalpingographie anormale contre 45% chez celles ayant une hystérosalpingographie normale. Il semblerait par conséquent que les anomalies utérines ne soient pas un facteur de stérilité chez ces femmes.
- Facteurs cervico-vaginaux :
Anomalies cervico-vaginales structurales : Pour L. COUSINS[95], la présence d'anomalies du col utérin et du vagin n'a pas d'influence en matière de stérilité (41% de stérilité en cas d'anomalies, 46% sans anomalies, et 46% dans un groupe témoin). D'autres auteurs n'ont pas les mêmes conclusions. Ainsi, L. BOUBLI[94] rapporte un taux de 77% de stérilité en cas d'anomalies du vagin seules, et de 61% en cas d'anomalies du col utérin et du vagin. Il semblerait, à l'heure actuelle, que les études effectuées sur ce sujet ne permettent pas d'arriver à une conclusion définitive.
Anomalies de la glaire cervicale : ROSENFELD et BRONSON ont rapporté une fréquence plus élevée de tests post-coïtaux médiocres chez les femmes DES (75%), avec des conséquences péjoratives. Cette notion est aussi rapportée par A. CABAU. Il n'y aurait, en tout cas, pas d'étude spécifique consacrée à ce sujet.
- Facteur tubaire :
Ce facteur de stérilité est déjà suggéré intuitivement par les aspects rencontrés en hystérosalpingographie dès les premières publications au sujet des femmes DES : La partie des trompes dénommée "isthme" est horizontalisée, et les trompes sont étirées vers le bas. Des publications plus récentes[94] confirment l'existence d'un facteur de stérilité lié aux trompes chez les femmes DES, soit en raison d'une obstruction des trompes, soit à cause de l'existence d'une endométriose des trompes. L. BOUBLI cite le chiffre de 42% d'anomalies des trompes chez des femmes DES suivies pour une stérilité. A notre connaissance, aucune étude spécifique consacrée à la perméabilité des trompes chez les femmes DES n'a été publiée à ce jour.
- Facteur endocrinien :
Des perturbations de la fonction hormonale de l'ovaire avaient déjà été mentionnées par M. BIBBO en 1977. Une étude de M. R. PERESS (cité par D. DARGENT[96] va aussi dans ce sens : Cet auteur a étudié 32 femmes exposées et 18 non exposées (dont 9 non hirsutes et bien réglées, et 9 hirsutes et mal réglées). L'hirsutisme est retrouvé dans 72% des cas et les perturbations menstruelles dans 50% des cas chez les les femmes exposées au DES (ce qui va, d'ailleurs, à l'encontre des études publiées sur le cycle menstruel de ces femmes[97][98]. Le taux de testostérone, de delta-4-androstène-dione, de TBG et de LH mesurés chez les femmes exposées sont identiques à ceux des femmes non exposées hirsutes, et significativement plus élevés que ceux des femmes non exposées non hirsutes. Les taux de DHEA sont , par contre, plus bas dans le groupe des femmes exposées. Ce qui suggère que l'
- Facteur ovulatoire :
L. BOUBLI[94] rapporte 38% de troubles de l'ovulation chez les femmes exposées au DES contre 56% dans un groupe témoin (non significatif). A. CABAU (cité par I. BURESI[99] par contre insiste sur la fréquence des troubles ovulatoires. Cette notion, généralement admise, n'a cependant jamais été démontrée scientifiquement, et les publications concernant la réponse ovarienne à des traitements de stimulation de l'ovulation (JONES) ont tendance à l'infirmer. (JONES retrouve 44, 5% d'ovocytes pré-ovulatoires, 26, 7% d'ovocytes immatures, et 28, 7% d'ovocytes dégénératifs chez les femmes DES ayant reçu une stimulation de l'ovulation, ce qui est identique aux chiffres retrouvés chez des patientes non exposées au DES.
J. BERGER[100] notait (avec une significativité statistique) une fréquence plus élevée de l'endométriose chez les femmes exposées au DES (64% contre 40% dans le groupe témoin). A. CABAU insiste aussi sur cette fréquence. STILLMAN, cependant, retrouve une fréquence plus élevée, mais non significative (50% contre 39% dans le groupe témoin).
- Facteur vasculaire :
Depuis légèrement plus d'une dizaine d'années, plusieurs auteurs, dont nous-même[101][102], ont mis en évidence des anomalies de la vascularisation utérine lors de certaines périodes du cycle menstruel, ces anomalies étant susceptibles de jouer un rôle néfaste dans l'implantation de l'œuf fécondé au niveau de l'endomètre. L'intêret d'un traitement préventif par l'aspirine a été évoqué par plusieurs auteurs[103], et ce traitement fait désormais partie de l'arsenal classique des traitements proposés aux femmes exposées au DES.
En définitive, les études scientifiques ne permettent pas de préciser clairement un ou plusieurs facteurs de stérilité ches les femmes exposées au DES. Chaque cas reste unique, et chaque couple doit bénéficier d'un bilan de stérilité "habituel" qui permettra quelquefois de retrouver l'ou les causes de la stérilité. Certaines notions se dégagent cependant, concernant la stérilité chez les femmes exposées au DES :
- Les anomalies utérines, cervicales, ou vaginales ne semblent pas entrer en jeu.
- Les facteurs hormonal et ovulatoire ne semblent pas avoir plus d'importance que dans la population générale.
- Il faut par contre être plus attentif aux anomalies tubaires ainsi qu'aux anomalies de la glaire cervicale, aux anomalies de la vascularisation utérine, et savoir rechercher avec soin une endométriose.
Conséquences sur l'évolution des grossesses
Les femmes exposées au DES in utero, quand elles sont enceinte à leur tour, sont significativement plus exposées que la population générale à certaines complications de la grossesse.
A. L. HERBST, en 1981[104], dans une étude incluant 338 patientes exposées au DES in utero (dont 150 qui étaient enceinte pour la première fois ("primigestes") ) comparées à un groupe témoin de 298 femmes (dont 181 "primigestes"), mettait l'accent sur une incidence accrue des avortements spontanés, des grossesses extra-utérines, et des accouchements prématurés dans le groupe des femmes DES (que ce soit chez les "primigestes" ou dans l'ensemble des grossesses confondues). Cette importante étude est résumée dans les deux tableaux ci-dessous :
Tableau 1 : Devenir des grossesses chez les primigestes :
| Patientes DES (n= 150) | Groupe témoin (n= 181) | p | |
|---|---|---|---|
| IVG | 32 | 43 | |
| Grossesses en cours | 4 | 8 | |
| Grossesses gémellaires | 0 | 2 | |
| Grossesses évaluables | 114 | 128 | |
| Accouchement à terme | 59 (52%) | 106 (83%) | |
| Accouchement prématuré | 23 (20%) | 8 (6%) | |
| Avortement spontané à moins de 15 S. A (3 mois) | 19 | 12 | |
| Avortement spontané entre 16 et 28 S. A. | 5 | 2 | |
| TOTAL des avortements | 21% | 11% | < 0,001 |
| Grossesses extra-utérines | 8 (7%) | 0 | < 0,005 |
Tableau 2 : Devenir de l'ensemble des grossesses :
| Patientes DES | Groupe témoin | |
|---|---|---|
| Nombre de femmes avec des grossesses "évaluables" | 122 | 141 |
| Nombre de grossesses "évaluables" | 212 | 254 |
| Accouchement à terme | 110 (52%) | 205 (81%) |
| Naissances vivantes (incluant naissances à terme et prématurés) | 142 (67%) | 213 (84%) |
| Grossesses "perdues" (morts périnatales et avortements spontanés) | 58 (27%) | 40 (16%) |
| Grossesses extra-utérines | 12 (5, 7%) | 1 (0, 3%) |
R. H. KAUFMAN, en 1984[105], étudie 676 patientes DES ayant toutes eu des hystérosalpingographies, dont 327 vont débuter une grossesse. Il démontre que l'existence d'anomalies à l'hystérosalpingographie est corrélée positivement à un "mauvais" déroulement des grossesses (avortements spontanés, prématurité, grossesses extra-utérines.
D'autres études, parues entre 1980 et 1995[106][107], [108], [99], [109], [110], [111], [112], [113], [114], [115], [116], [117], [118], [119], [120], [121], [122], vont cerner le problème des pathologies obstétricales dues à l'exposition au DES. Les principales pathologies figurent ci dessous.
Avortements spontanés
Le risque d'avortements spontanés précoces (avant la 15ème semaine d'aménorrhée ou 15 S. A. ) et tardifs (entre 16 et 28 S. A. ) est indéniablement augmenté dans la population des femmes DES, comme le démontrent la majorité des études résumées dans le tableau ci dessous :
Taux d'avortements spontanés (en % des grossesses) chez les patientes DES :
| Auteur | Patientes DES | Groupe témoin |
|---|---|---|
| COUSINS | 18, 5 | 20, 5 |
| HERBST | 21, 6 | 12, 6 |
| KAUFMAN | 22, 3 | 8, 2 |
| BERGER | 48, 4 | |
| SCHMIDT | 24, 2 | |
| BARNES | 25, 9 | 16, 1 |
| SANDBERG | 22, 0 | 7, 0 |
| MANGAN | 18, 3 | 8, 4 |
| PONS | 42, 0 | 10, 0 |
E. C. SANDBERG[119] a montré, en comprenant plusieurs études, que le taux d'avortements spontanés est constant, dès la première grossesse. Il a aussi montré que la présence ou l'absence d'anomalies cervico-vaginales ne permet pas de déterminer une population particulièrement menacée par les avortements (13/46, soit 28% chez les porteuses d'anomalies, contre 10/55, soit 18% chez les non porteuses).
R. H. KAUFMAN[123] ne retrouve pas non plus d'éléments prédictifs spécifiques d'avortements dans les données des hystérographies en ce qui concerne la forme de la cavité utérine, mais il avait retrouvé une corrélation positive entre laa présence de bords irréguliers de la cavité et le taux d'avortements.
Grossesses extra-utérines
Accouchements prématurés
Autres problèmes
Déroulement du travail
Pronostic fœtal et survie néonatale
Suivi des grossesses des femmes exposées in utero au DES
En France, depuis le décret du 2 juillet 2006, les femmes exposées in utero au DES peuvent bénéficier d'un congé maternité avant le début officiel du congé de maternité ou du congé pathologique. Les indemnités journalières versées par la sécurité sociale sont en effet plus importantes en cas de congé maternité qu'en cas d'arrêt de travail. Un formulaire spécifique doit être rempli par un médecin spécialiste en gynécologie ou gynéco-obstétrique.
Voir aussi
Notes et références
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, «Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme» sur http ://monographs. iarc. fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ (fr) Ministère de la Solidarité, de la Santé, et de la Protection sociale. Exposition au diéthylstilbestrol (DES) in utero, prise en charge par le praticien. Imprimerie nationale. Mars 1989.
- (fr) SPIRA A. & Coll. L'administration de diéthylstilbestrol (DES) au cours de la grossesse. Un problème de santé publique. Rev. Epidem. Santé publique. 1983, 31, 249-272.
- ↑ (en) DODDS E. G. Estrogenic activity of certain synthetic compounds Nature 1938, 141, 247-249.
- ↑ (en) SMITH O. W. Diethylstilbestrol in the prevention and treatment of complications of pregnancy. Am. J. Obst. Gynecol. 1948, 56, 821-826.
- ↑ (en) SMITH O. W. & Coll. The influence of diethylstilbestrol on the progress and outcome of pregnancy based on a comparison of treated with untreated primigravidas. Am. J. Obstet. Gynecol. 1949, 58, 994-1002.
- ↑ (en) DIECKMANN W. J. & Coll. Dœs administration of diethylstilbestrol during pregnancy have therapeutic value? Am. J. Obst. Gynecol. 1953, 66, 1002-1008.
- ↑ (en) HERBST A. L. & Coll. Adenocarcinoma of the vagina in adolescence. Cancer 1970, 25, 745-757.
- ↑ (en) HERBST A. L. & Coll. Adenocarcinoma of the vagina association of maternal stilbestroltherapie with tumor appearance in young women. N. Engl. J. Med. 1971, 284, 878-881.
- ↑ (fr) DARGENT D. Le DES syndrome : Quoi de neuf ? Encyclopédie Med. Chir. Gyn. 1991, I, 2e F. r. 85-A10.
- ↑ (fr) DARGENT D. & Coll. Adénocarcinome à cellules claires (ACCC) du vagin : Rôle du diéthylstilbestrol (DES) : Faits et hypothèses. JOBGYN 1995, 3, 179-194.
- ↑ (en) VESSEY M. P. Epidemiological studies of the effects of diethylstilbestrol. IARC Sci. Publ. 1989, 96, 335-348.
- ↑ (en) EMENS J. M. Continuing problems with diethylstilbestrol. Br. J. Obstet. Gynæcol. 1994, 101, 748-750.
- ↑ (fr) BLANC B. Historique. In Les enfants du Distilbene. p. 1-4. (Ed. Arnette. Paris. 1991). ISBN 2-7184-0540-6
- ↑ (en) APM Mondial. Programme de prévention pour les "enfants du Distilbene" à la télévision anglaise. Channel 4. Londres. 9 Novembre 1989.
- ↑ (fr) Ministère de la Solidarité, de la Santé, et de la Protection sociale. Exposition au diéthylstilbestrol (DES) in utero, prise en charge par le praticien. Imprimerie nationale. Mars 1989.
- ↑ (fr) EPELBOIN S., BULWA S. Pharmacovigilance et reproduction : Le mauvais exemple du Distilbene. Contracept. Fertil. Sex. 1993, 21 (9) , 658-672.
- ↑ (fr) Site du Réseau DES. France
- ↑ Cour de cassation, 24 septembre 2009, 1re chambre civile.
- ↑ (fr) Jan Langman, Abrégé d'embryologie médicale. Masson éditeur. Paris. 1976. ISBN 2-225 43428-X
- ↑ (fr) Ulrich Drews, Atlas de poche d'embryologie. Éditions Flammarion Médecine-Sciences. Paris. 1994. ISBN 2-257-10115-4
- (en) HENDRY W. J., LEAVITT W. W. Altered morphogenesis of the immature hamster uterus following neonatal exposure to diethylstilbestrol. Differenciation 1993, 52 (3) , 221-227.
- ↑ (en) MARSELOS M., TOMATIS L. Diethylstilbestrol : II, pharmacology, toxicology, and carcinogenecity in experimental animals. Eur. J. Cancer 1992, 29A (1) , 149-155.
- ↑ (en) PLAPINGER L. Morphological effects in diethylstilbestrol on neonatal mouse uterus and vagina. Cancer Res. 1981, 41, 4667-4670.
- ↑ (en) WALKER B. E. Animal models of prenatal exposure to diethylstilbestrol. IARC Sci. Publ. 1989, 96, 349-364
- ↑ (en) MARSELOS M., TOMATIS L. Diethylstilbestrol : II, pharmacology, toxicology, and carcinogenecity in experimental animals. Eur. J. Cancer 1992, 29A (1) , 149-155.
- ↑ (fr) PONS J. C. Physiopathologie du DES-syndrome. In Les enfants du Distilbene. p5-10 (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- ↑ (fr) PONS J. C. Physiopathologie du DES-syndrome. In Les enfants du Distilbene. p5-10 (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- (en) WORDINGER R. & Coll. Effect of in utero exposure to diethylstilbestrol on ontogeny of uterine glands in neonatal mice. J. Reprod. Feril. 1991, 92 (1) , 209-216
- ↑ (fr) MINH H. N. & Coll. De l'embryogénèse à la pathogénie des actions du diéthylstilbestrol sur le tractus génital féminin. Presse Med. 1993, 22 (22) , 1052-1057.
- ↑ (fr) PONS J. C. Physiopathologie du DES-syndrome. In Les enfants du Distilbene. p5-10 (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- (en) MARSELOS M., TOMATIS L. Diethylstilbestrol : I, pharmacology, toxicology, and carcinogenecity in humans. Eur. J. Cancer 1992, 28A (6-7) , 1182-1189.
- ↑ (en) MARSELOS M., TOMATIS L. Diethylstilbestrol : II, pharmacology, toxicology, and carcinogenecity in experimental animals. Eur. J. Cancer 1992, 29A (1) , 149-155.
- ↑ (fr) PONS J. C. Physiopathologie du DES-syndrome. In Les enfants du Distilbene. p5-10 (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- ↑ (en) MARSELOS M., TOMATIS L. Diethylstilbestrol : II, pharmacology, toxicology, and carcinogenecity in experimental animals. Eur. J. Cancer 1992, 29A (1) , 149-155.
- ↑ (en) WALKER B. E. Animal models of prenatal exposure to diethylstilbestrol. IARC Sci. Publ. 1989, 96, 349-364.
- ↑ (fr) BELAÏSCH J. «L'exposition au diéthylstilbœstrol au cours de la vie intra-utérine. Signes qui doivent la faire évoquer. Implications thérapeutiques.» J. Gynecol. Obstét. Biol. Reprod. 1983, 12 (5) , 481-488.
- (fr) MINH H. N. & Coll. De l'embryogenèse à la pathogénie des actions du diéthylstilbestrol sur le tractus génital féminin. Presse Med. 1993, 22 (22) , 1052-1057.
- ↑ (en) SMITH O. W. Diethylstilbestrol in the prevention and treatment of complications of pregnancy. Am. J. Obst. Gynecol. 1948, 56, 821-826.
- ↑ (fr) PONS J. C. & Coll. Devenir des grossesses des patientes exposées in utero au diéthylstilbestrol. Enquête du Collège national des gynécologues et obstétriciens français. J. Gynecol. Obstet. Biol. Reprod. 1988, 17 (3) , 307-316.
- (en) KAUFMAN R. H. & Coll. Upper genital tract changes associated with exposure in utero to diethylstilbestrol. Am. J. Obstet. Gynecol. 1977, 128, 51-59.
- ↑ (fr) PONS J. C. & Coll. Devenir des grossesses des patientes exposées in utero au diéthylstilbestrol. Enquête du Collège national des gynécologues et obstétriciens français. J. Gynecol. Obstet. Biol. Reprod. 1988, 17 (3) , 307-316.
- ↑ (en) HERBST A. L. & Coll. Effects of maternal DES ingestion on the female genital tract. Hospital practice 1975, 51-55.
- ↑ (en) ROBBOY S. J. & Coll. Cytology of 575 young women with prenatal exposure to DES. Obstet. Gynecol. 1976, 48, 511.
- ↑ (en) NOLLER K. L. & Coll. Maturation of vaginal and cervical epithelium in women exposed in utero to DES (DESAD project). Am. J. Obstet. Gynecol. 1983, 146, 279.
- (en) ANTONIOLI D. A. & Coll. Natural history of DES associated genital lesions : cervical ectopy and cervico-vaginal hood. Am. J. Obstet. Gynecol. 1980
- ↑ (en) HERBST A. L. & Coll. Reproductive and gynecologic surgical experience in diethylstilbestrol exposed daughters. Am. J. Obstet. Gynecol. 1081, 141 (8) , 1019-1028.
- ↑ (en) ROBBOY S. J. & Coll. Dysplasia and cytologic findings in 4589 young women enrolled in DESAD project. Am. J. Obstet. Gynecol. 1981, 140, 579.
- ↑ (en) FOWLER N. C. & Coll. Risks of cervical intræpithelial neoplasia among DES exposed women. Obstet. Gynecol. 1981, 158, 720-724.
- ↑ (en) ROBBOY S. J. & Coll. Increased incidence of cervical and vaginal dysplasia in 3980 DES exposed young women. JAMA 1984, 252, 2979-2983.
- (fr) DARGENT D. Le DES syndrome : Quoi de neuf ? Encyclopédie Med. Chir. Gyn. 1991, I, 2eF. r. 85-A10.
- (fr) LEMAIRE B. L'adénose cervico-vaginale post-DES. In Les enfants du Distilbène. p11-24. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (fr) KHOUZAMI A. & Coll. Papillomavirus humain (HPV) et néoplasie vaginale intra-épithéliale (VaIN) chez les femmes exposées au DES in utero. In Les enfants du Distilbène. p33-35. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (en) BORNSTEIN J. & Coll. Human papillomavirus associated with vaginal intræpithelial neoplasia in women exposed to diethylstilbestrol in utero. Obstet. Gynecol. 1987, 70, 1.
- ↑ (en) JEFFRIES J. & Coll. Structural anomalies of the cervix and vagina in women enrolled in the diethylstilbœstrol adenosis (DESAD) project. Am. J. Obstet. Gyn. 1984, 148, 59.
- ↑ (fr) BELAÏSCH J. L'exposition au déthylstilbœstrol au cours de la vie intra-utérine. Signes qui doivent la faire évoquer. Implications thérapeutiques. J. Gynecol. Obstét. Biol. Reprod. 1983, 12 (5) , 481-488.
- ↑ (fr) BURESI I., LEDEE N. La patiente exposée in utero au Distilbene. (Résumé de la journée d'enseignement du 15 mai 1992, hôpital Antoine-Béclère, Clamart). La lettre du Gynécologue 1993, 179, 9-11.
- ↑ (en) ANTONIOLI D. A., BURKE L. Natural history of DES associated genital lesions : cervical ectopy and cervico-vaginal hood. Am. J. Obstet. Gynecol. 1980.
- ↑ (en) HERBST A. L. & Coll. Reproductive and gynecologic surgical experience in diethylstilbœstrol exposed daughters. Am. J. Obstet. Gynecol. 1981, 141 (8) , 1019-1028.
- (fr) DELPERO J. R. & Coll. Tumeurs du vagin à cellules claires, adénocarcinomes à cellules claires. Étude comparative avec les épithéliomas pavimenteux malpighiens. In Les enfants du Distilbène. p41-49. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (fr) BLANC B., DELPERO J. R. L'adénocarcinome à cellules claires du vagin. In Les enfants du Distilbène. p37-40. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (en) HERBST A. L., SCULLY R. E. Adenocarcinoma of the vagina in adolescence. Cancer 1970, 25, 745-757.
- ↑ (en) HERBST A. L. & Coll. Clear cell adenocarcinoma of the vagina and cervix in girls : analysis of 170 registry cases. Am. J. Obstet. Gynecol. 1974, 119, 713-724.
- ↑ (fr) DARGENT D. & Coll. Adénocarcinome à cellules claires (ACCC) du vagin : Rôle du diéthylstilbœstrol (DES) : Faits et hypothèses. 2) Pronostic des ACCC du vagin et déductions thérapeutiques. Synthèse. JOBGYN 1995, 3, 179-194.
- ↑ (fr) DARGENT D. & Coll. Adénocarcinome à cellules claires (ACCC) du vagin : Rôle du diéthylstilbœstrol (DES) : Faits et hypothèses. 2) Pronostic des ACCC du vagin et déductions thérapeutiques. Synthèse. JOBGYN 1995, 3, 179-194.
- ↑ (fr) BLANC B. Historique. In Les enfants du Distilbène. p1-4. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (fr) BLANC B., DELPERO J. R. L'adénocarcinome à cellules claires du vagin. In Les enfants du Distilbène. p37-40. (Ed. Arnette, Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (en) HERBST A. L. & Coll. Epidemiologic aspects and factors related to survival in 384 registry cases of clear cell adenocarcinoma of the vagina and cervix. Am. J. Obstet. Gynecol. 1979, 135, 876-896.
- ↑ (en) Site de la FIGO : classification des cancers gynécologiques
- (fr) LEFRANC J. P. & Coll. Tumeurs du vagin et lésions apparentées. Encyclopédie Med. Chir. Gyn. 1991, III, 530 A10.
- ↑ (en) Site de la FIGO : Cancers gynécologiques
- ↑ (fr) Ministère de la Solidarité, de la Santé et de la Protection sociale. Exposition au diéthylstilbestrol (DES) in utero, prise en charge par le praticien. Imprimerie Nationale. Mars 1989.
- ↑ (en) HERBST A. L., SCULLY R. E. Adenocarcinoma of the vagina in adolescence. Cancer 1970, 25, 745-751.
- ↑ (en) DECHERNEY A. & Coll. Structure and function of the fallopian tubes following exposure to DES during gestation. Fertil. Steril. 1981, 136, 741-745.
- ↑ (en) KAUFMAN R. H. & Coll. Upper genital tract changes and pregnancy outcome in offspring exposed in utero to DES. Am. J. Obstet. Gynecol. 1988, 148 (7) , 973-981.
- ↑ (en) KAUFMAN R. H. & Coll. Upper genital tract changes and pregnancy outcome in offspring exposed in utero to DES. Am. J. Obstet. Gynecol. 1988, 148 (7) , 973-981.
- ↑ (fr) BLANC B. Les lésions utérines et annexielles. In Les enfants du Distilbene. p51-60. (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- ↑ (en) HANEY A. F. & Coll. Diethylstilbestrol induced upper genital tract abnormalities. Fertil. Steril. 1979, 31, 142-146.
- ↑ (en) HORNSBY P. P. & Coll. Effects on the menstrual cycle of in utero exposure to diethylstilbestrol. Am. J. Obstet. Gynecol. 1994, 170 (3) , 709-715.
- ↑ (en) COUSINS L. & Coll. Reproductive outcome of women exposed to diethylstilbestrol in utero. Obstet. Gynecol. 1980, 56, 7076.
- ↑ (en) VISCOMI G. N. & Coll. Ultrasound detection of uterine abnormalities after diethylstilbestrol (DES) exposure. Radiology 1980, 136, 733-735.
- ↑ (en) HERBST A. L. & Coll. Reproductive and gynecologic surgical experience in diethylstilbœstrol exposed daughters. Am. J. Obstet. Gynecol. 1981, 141 (8) , 1019-1028
- ↑ (fr) BELAÏSCH J. L'exposition au diethylstilbœstrol au cours de la vie intra-utérine. Signes qui doivent la faire évoquer. Implications thérapeutiques. J. Gynecol. Obstet. Biol. Reprod. 1983, 12 (5) , 481-488
- ↑ (fr) MINH H. N. & Coll. De l'embryogenèse à la pathogénie des actions du diéthylstilbestrol sur le tractus génital féminin. Presse Med. 1993, 22 (22) , 1052-1057
- (fr) BLANC B. Les lésions utérines et annexielles. In Les enfants du Distilbene. p51-60. (Ed. Arnette. Paris. 1991) (ISBN 2-7184-0540-6)
- ↑ (en) KAUFMAN R. H. & Coll. Upper genital tract changes and infertility in diethylstilbestrol-exposed women. Am. J. Obstet. Gynecol. 1986, 154, 1312-1318.
- ↑ (fr) BURESI I., LEDEE. N. La patiente exposée in utero au Distilbene. (Résumé de la journée d'enseignement du 15 Mai 1992, Hôpital Antoine Béclère, Clamart). La lettre du Gynécologue 1993, 179, 9-11.
- ↑ (en) KAUFMAN R. H. & Coll. Upper genital tract changes and infertility in diethylstilbestrol-exposed women. Am. J. Obstet. Gynecol. 1986, 154, 1312-1318.
- ↑ (en) DECHERNEY A. & Coll. Structure and function of the fallopian tubes following exposure to DES during gestation. Fertil. Steril. 1981, 36, 741-745.
- ↑ (fr) BELAÏSCH J. L'exposition au diethylstilbœstrol au cours de la vie intra-utérine. Signes qui doivent la faire évoquer. Implications thérapeutiques. J. Gynecol. Obstet. Biol. Reprod. 1983, 12 (5) , 481-488
- ↑ (en) HERBST A. L. & Coll. Reproductive and gynecologic surgical experience in diethylstilbestrol exposed daughters. Am. J. Obstet. Gynecol. 1981, 141 (8) , 1019-1028.
- ↑ (en) SENEKJIAN E. K. & Coll. Infertility among daughters either exposed or not exposed to diethylstilbestrol. Am. J. Obstet. Gynecol. 1988, 158, 493-498.
- ↑ (en) KAUFMAN R. H. & Coll. Upper genital tract changes and infertility in diethylstilbestrol-exposed women. Am. J. Obstet. Gynecol. 1986, 154, 1312-1318.
- (fr) BOUBLI L. & Coll. Les conséquences sur la fonction de reproduction. In Les enfants du Distilbene. p 69-80. (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- ↑ (en) COUSINS L. & Coll. Reproductive outcome of women exposed to diethylstilbœstrol in utero. Obstet. Gynecol. 1980, 56, 7076
- ↑ (fr) DARGENT D. Le D. E. S. syndrome : Quoi de neuf ? Encyclopédie Med. Chir. Gyn. 1991, I, 2e F. r. 85-A10
- ↑ (en) COUSINS L. 1 Coll. Reproductive outcome of women exposed to diethylstilbestrol in utero. Obstet. Gynecol. 1980, 56, 7076.
- ↑ (en) HORNSBY P. P., WILCOX A. J., WEINBERG C. R., HERBST A. L. Effects on the menstrual cycle of in utero exposure to diethylstilbestrol. Am. J. Obstet. Gynecol. 1994, 170 (3) , 709-715.
- (fr) BURESI I., LEDEE N. La patiente exposée in utero au Distilbene. (Résumé de la journée d'enseignement du 15 Mai 1992, Hôpital Antoine-Béclère, Clamart). La lettre du Gynécologue 1993, 179, 9-11.
- ↑ (en) BERGER J., GOLDSTEIN D. P. Impaired reproductive performance in DES exposed women. Obstet. Gynecol. 1980, 55, 25-28.
- ↑ (en) B. SALLE, P. SERGEANT, A. AWADA, V. BIED-DAMON, P. GAUCHERAND & al. Transvaginal ultrasound studies of vascular and morphological changes in uterus exposed in utero to diethylstilbestrol during menstrual cycles. Hum. Reprod. 11 (1996) 2531-2536.
- ↑ (fr) B. SALLE, A. AWADA, P. GAUCHERAND, R. C. RUDIGOZ. Etude échographique et Doppler couleur des utérus Distilbene. Rev. Prat. Gynecol. Obstet. 2 (1997) 19-22.
- ↑ (en) WADA I., CHIN HSU C., WILLIAMS G., MACNAMEE M. C., BRINDSEN P. The benefits of low-dose aspirin therapy in women with impaired uterine perfusion during assisted conception. Human Reproduction 1994, 9 (10) , 1954-1957.
- ↑ (en) HERBST A. L., HUBBY M. M., AZIZI F., MAKII N. M. Reproductive and gynecologic surgical experience in diethylstilbestrol exposed daughters. Am. J. Obstet. Gynecol. 1981, 141 (8) , 1019-1028.
- ↑ (en) KAUFMAN R. H., NOLLER K., ADAM E., IRWIN J., GRAY M., & Coll. Upper genital tract abnormalities and pregnancy outcome in diethylstilbestrol-exposed progeny. Am. J. Obstet. Gynecol. 1984, 148 (7) , 973-981.
- ↑ (en) SMITH O. W. & Al. The influence of diethylstilbestrol on the progress and outcome of pregnancy. Am. J. Obstet. Gynecol. 1949, 58, 994-1002.
- ↑ (en) HERBST A. L. & Al. Reproductive and gynecologic surgical experience in diethylstilbestrol exposed daughters. Am. J. Obstet. Gynecol. 1981, 141 (8) , 1019-1028.
- ↑ (fr) BELAÏSCH J. L'exposition au diéthylstilbestrol au cours de la vie intra-utérine. Signes qui doivent la faire évoquer. Implications thérapeutiques. J. Gynecol. Obstet. Biol. Reprod. 1983, 12 (5) , 481-488.
- ↑ (fr) PONS J. C. & Coll. Devenir des grossesses des patientes exposées in utero au diéthylstilbestrol. Enquête du Collège national des gynécologues et obstétriciens Français. J. Gynecol. Obstet. Biol. Reprod. 1988, 17 (3) , 307-316.
- ↑ (en) KAUFMAN R. H. & Al. Upper genital tract changes and pregnancy outcome in offspring exposed in utero to DES. Am. J. Obstet. Gynecol. 1988, 137, 299-307.
- ↑ (en) COUSINS L. & Al. Reproductive outcome of women exposed to diethylstilbestrol in utero. Obstet. Gynecol. 1980, 56, 7076.
- ↑ (fr) BOUBLI L., D'ERCOLE C. Les conséquences sur la fonction de reproduction. In Les enfants du Distilbene. p 69-80. (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- ↑ (en) BERGER J., GOLDSTEIN D. P. Impaired reproductive performance in DES exposed women. Obstet. Gynecol. 1980, 55, 25-28.
- ↑ (en) BUITENDIJK S. E., VERLOOVE-VANHORICK S. P. DES and preterm birth rate. Pædiatr. Perinat. Epidemiol. 1993, 7 (2) , 223-224.
- ↑ (en) LEVINE R. U., BERKOWITZ K. M. Conservative management and pregnancy outcome in diethylstilbestrol-exposed women with and without gross genital tract abnormalities. Am. J. Obstet. Gynecol. 1993, 169 (5) , 1125-1129.
- ↑ (en) LUDMIR J. & Al. Management of the diethylstilbestrol-exposed pregnant patient : A prospective study. Am. J. Obstet. Gynecol. 1987, 157 (3) , 665-669.
- ↑ (en) MITTENDORF R., WILLIAMS M. A. Stilbœstrol exposure in utero and risk of pre-eclampsia. Lancet 1995, 345, 265-266.
- ↑ (fr) PONS J. C. & Coll. Prise en charge des grossesses des patientes exposées in utero au diethylstilbestrol. In Les enfants du Distilbene. p 69-80. (Ed. Arnette. Paris. 1991. ) ISBN 2-7184-0540-6
- (en) SANDBERG E. C. & Al. Pregnancy outcome in women exposed to diethylstilbestrol in utero. Am. J. Obstet. Gyn. 1981, 140, 194.
- ↑ (en) SINGER M. S. & Al. Incompetent cervix in hormone-exposed offspring. Br. J. Obstet. Gynæcol. 1977, 6, 625-626.
- ↑ (en) THORP J. M. & Al. Antepartum and intrapartum events in women exposed in utero to diethylstilbestrol. Obstet. Gynecol. 1990, 76 (5) , 828-832.
- ↑ (en) WILLIAMSON H. O. Spontaneous rupture of gravid uterus in a patient with diethylstilbestrol-type genital changes. Am. J. Obstet. Gynecol. 1984, 150 (2) , 158-160.
- ↑ (en) KAUFMAN R. H. & Al. Upper genital tract abnormalities and pregnancy outcome in diethylstilbestrol-exposed progeny. Am. J. Obstet. Gynecol. 1984, 148 (7) , 973-981.
Ouvrages de référence
- Les Enfants du Distilbène. Sous la direction de Bernard BLANC. Éditions Arnette. Paris. 1991. (ISBN 2-7184-0540-6)
- Abrégé d'embryologie médicale. Jan LANGMAN. Masson éditeur. Paris. 1976. (ISBN 2-225 43428-X)
- Atlas de poche d'embryologie. Ulrich DREWS. Éditions Flammarion Médecine-Sciences. Paris. 1994. (ISBN 2-257-10115-4)
Liens externes
Recherche sur Google Images : |
|
"Diethylstilbestrol (agonist)" L'image ci-contre est extraite du site chemicalsimulations.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (513 x 291 - 42 ko - gif)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 06/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.



 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité